 _MASTER'S EYE
_MASTER'S EYE
さらに1滴滴下してみました。
|
今度は塩基性に突入してしまいました。当然です!だって水溶液は完全に中性だったところへ
![]() を1滴滴下してしまったわけですから。中性状態における
を1滴滴下してしまったわけですから。中性状態における
![]() や
や
![]() のモル濃度である
のモル濃度である![]() mol/
mol/![]() よりも多いのは今度は
よりも多いのは今度は
![]() ですから、水の仕事手順水の仕事手順に飛びたい方はどうぞ。あちらからも、欄外のリンクからこちらにちゃんと戻ってこれますよ。でご説明したように先に
ですから、水の仕事手順水の仕事手順に飛びたい方はどうぞ。あちらからも、欄外のリンクからこちらにちゃんと戻ってこれますよ。でご説明したように先に
![]() のモル濃度から計算していきます。
のモル濃度から計算していきます。
![]() 1滴には
1滴には
![]() が
が![]() mol含まれていますから
mol含まれていますから
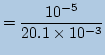 |
||
| (17) |
これにより「水のイオン積」[H+][OH-]=10-14のことですよ。を保つために
![]() のモル濃度は
のモル濃度は
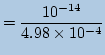 |
||
| (18) |
となります。したがってpHは
| pH | ||
| (19) |
と求まります。また大きく跳びましたね。pHの変化量は
| (20) |
です。一見すると疑問に思うかもしれません。酸側からの最後の1滴(100滴目)の変化量と塩基側に向かう最初の1滴(101滴目)のpHの変化量は同じではないのかという思いがおありの方もいらっしゃるでしょう。確かに物質量の変化は同じです。
しかしpHはモル濃度で見てますから、当然体積が変化しているとpHの変化量が同じになることはありませんね。したがって、多少のズレが生じます。
つまりこのように今後は塩基側にpHがどんどんと変化していきます。ではこれまでのもまとめて、200滴までの表を表8に示しておきます。見比べながらpHがどのように変化しているかを想像してみてください。
ホーム > 化学のトップページ > 目次 > 酸・塩基 > 滴定曲線 > NaOHを101滴滴下