 _MASTER'S EYE
_MASTER'S EYE
では、その後どんどん滴下していって、90滴目の滴下を終えたところを考えてみます。
表4を見て下さい。
![]() を90滴滴下した結果、溶液中には酸を示す
を90滴滴下した結果、溶液中には酸を示す
![]() の物質量が
の物質量が
![]() mol10×10-5molはNaOHを90滴滴下という滴下量から計算した値ですよ?となってしまいました。このときのモル濃度を考えてみましょう。水溶液の体積が19m
mol10×10-5molはNaOHを90滴滴下という滴下量から計算した値ですよ?となってしまいました。このときのモル濃度を考えてみましょう。水溶液の体積が19m![]() になりました。そこで水素イオン濃度は
になりました。そこで水素イオン濃度は
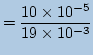 |
||
| (14) |
となります。でもまだ[
![]() ]は中性(つまり[
]は中性(つまり[
![]() ]と[
]と[
![]() ]がつりあった状態)の
]がつりあった状態)の![]() mol/
mol/![]() よりも大きいですね。そこでpHを求めてみると
よりも大きいですね。そこでpHを求めてみると
| pH | ||
| (15) |
となります。やっとpHが2を超えてます。正確にはもうすこし前の82滴目を滴下したときにpH=2を超えますが、ここで言いたいのは、以前pHの項pHのページに飛んでみますか?で説明したように、pHが1から2に変わるためにはモル濃度が
![]() にならなくてはならないということです。溶液1
にならなくてはならないということです。溶液1![]() 中の
中の
![]() の物質量が
の物質量が
![]() になったからpHが1上がったのです。では、次にまたpHが1上がるためにはさらに82滴必要なのでしょうか?
になったからpHが1上がったのです。では、次にまたpHが1上がるためにはさらに82滴必要なのでしょうか?
ホーム > 化学のトップページ > 目次 > 酸・塩基 > 滴定曲線 > NaOHを90滴滴下