 _MASTER'S EYE
_MASTER'S EYE
1滴目を滴下したときの計算はうまくいったでしょうか?自分で計算しないと決して理解できないですよ?ちなみにちゃんと計算していると、101滴目の計算のときにちょっとしたポイントが頭に入ります。ちょっとしたポイントですが大事なポイントです。
さて
![]() の2滴目を滴下するとどうなるでしょうか?下の表3を御覧下さい。
の2滴目を滴下するとどうなるでしょうか?下の表3を御覧下さい。
|
まず滴下された
![]() に含まれていた
に含まれていた
![]() の物質量は
の物質量は![]() molでした。だからその2滴目の
molでした。だからその2滴目の
![]() に中和された
に中和された
![]() も当然
も当然![]() molとなります。その結果、溶液10.2m
molとなります。その結果、溶液10.2m![]() 中に存在する
中に存在する
![]() の物質量は
の物質量は
![]() molとなります。
molとなります。
水はまず![]() mol/
mol/![]() を超えている多く存在する方から計算して、もう一方の値を決めるんでしたね水の仕事手順を参照。。したがって
を超えている多く存在する方から計算して、もう一方の値を決めるんでしたね水の仕事手順を参照。。したがって
![]() の方が大きいですから[
の方が大きいですから[
![]() ]は
]は
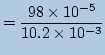 |
||
| (12) |
| pH | ||
| (13) |
となります。pHの変化はやはりわずか0.02です。
ホーム > 化学のトップページ > 目次 > 酸・塩基 > 滴定曲線 > NaOHを2滴滴下